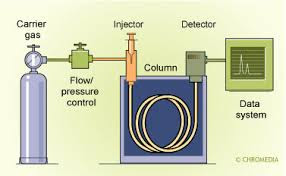
Instrument Kimia Spektrofotometer Serapan Atom (AAS)
Spektrofotometer Serapan Atom (AAS) adalah suatu alat yang digunakan pada metode analisis untuk penentuan unsur-unsur logam dan metaloid yang berdasarkan pada penyerapan absorbsi radiasi oleh atom bebas.
Prinsip Dasar
Spektrofotometer serapan atom (AAS) merupakan teknik analisis kuantitafif dari unsur-unsur yang pemakainnya sangat luas di berbagai bidang karena prosedurnya selektif, spesifik, biaya analisisnya relatif murah, sensitivitasnya tinggi (ppm-ppb), dapat dengan mudah membuat matriks yang sesuai dengan standar, waktu analisis sangat cepat dan mudah dilakukan. AAS pada umumnya digunakan untuk analisa unsur, spektrofotometer absorpsi atom juga dikenal sistem single beam dan double beam layaknya Spektrofotometer UV-VIS. Sebelumnya dikenal fotometer nyala yang hanya dapat menganalisis unsur yang dapat memancarkan sinar terutama unsur golongan IA dan IIA. Umumnya lampu yang digunakan adalah lampu katoda cekung yang mana penggunaanya hanya untuk analisis satu unsur saja.
Metode AAS berprinsip pada absorbsi cahaya oleh atom. Atom-atom menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung pada sifat unsurnya. Metode serapan atom hanya tergantung pada perbandingan dan tidak bergantung pada temperatur. Setiap alat AAS terdiri atas tiga komponen yaitu unit teratomisasi, sumber radiasi, sistem pengukur fotometerik. Teknik AAS menjadi alat yang canggih dalam analisis. Ini disebabkan karena sebelum pengukuran tidak selalu memerlukan pemisahan unsur yang ditentukan karena kemungkinan penentuan satu unsur dengan kehadiran unsur lain dapat dilakukan, asalkan katoda berongga yang diperlukan tersedia. AAS dapat digunakan untuk mengukur logam sebanyak 61 logam.
Sumber cahaya pada AAS adalah sumber cahaya dari lampu katoda yang berasal dari elemen yang sedang diukur kemudian dilewatkan ke dalam nyala api yang berisi sampel yang telah teratomisasi, kemudia radiasi tersebut diteruskan ke detektor melalui monokromator. Chopper digunakan untuk membedakan radiasi yang berasal dari sumber radiasi, dan radiasi yang berasal dari nyala api. Detektor akan menolak arah searah arus (DC) dari emisi nyala dan hanya mengukur arus bolak-balik dari sumber radiasi atau sampel. Atom dari suatu unsur pada keadaan dasar akan dikenai radiasi maka atom tersebut akan menyerap energi dan mengakibatkan elektron pada kulit terluar naik ke tingkat energi yang lebih tinggi atau tereksitasi. Jika suatu atom diberi energi, maka energi tersebut akan mempercepat gerakan elektron sehingga elektron tersebut akan tereksitasi ke tingkat energi yang lebih tinggi dan dapat kembali ke keadaan semula. Atom-atom dari sampel akan menyerap sebagian sinar yang dipancarkan oleh sumber cahaya. Penyerapan energi oleh atom terjadi pada panjang gelombang tertentu sesuai dengan energi yang dibutuhkan oleh atom tersebut.
Cara Kerja AAS :
1. pertama-tama gas di buka terlebih dahulu, kemudian kompresor, lalu ducting, main unit, dan komputer secara berurutan.
2. Di buka program SAA (Spectrum Analyse Specialist), kemudian muncul perintah ”apakah ingin mengganti lampu katoda, jika ingin mengganti klik Yes dan jika tidak No.
3. Dipilih yes untuk masuk ke menu individual command, dimasukkan nomor lampu katoda yang dipasang ke dalam kotak dialog, kemudian diklik setup, kemudian soket lampu katoda akan berputar menuju posisi paling atas supaya lampu katoda yang baru dapat diganti atau ditambahkan dengan mudah.
4. Dipilih No jika tidak ingin mengganti lampu katoda yang baru.
5. Pada program SAS 3.0, dipilih menu select element and working mode.Dipilih unsur yang akan dianalisis dengan mengklik langsung pada symbol unsur yang diinginkan
6. Jika telah selesai klik ok, kemudian muncul tampilan condition settings. Diatur parameter yang dianalisis dengan mensetting fuel flow :1,2 ; measurement; concentration ; number of sample: 2 ; unit concentration : ppm ; number of standard : 3 ; standard list : 1 ppm, 3 ppm, 9 ppm.
7. Diklik ok and setup, ditunggu hingga selesai warming up
8. Diklik icon bergambar burner/ pembakar, setelah pembakar dan lampu menyala alat siap digunakan untuk mengukur logam.
9. Pada menu measurements pilih measure sample.
10. Dimasukkan blanko, didiamkan hingga garis lurus terbentuk, kemudian dipindahkan ke standar 1 ppm hingga data keluar.
11. Dimasukkan blanko untuk meluruskan kurva, diukur dengan tahapan yang sama untuk standar 3 ppm dan 9 ppm.
12. Jika data kurang baik akan ada perintah untuk pengukuran ulang, dilakukan pengukuran blanko, hingga kurva yang dihasilkan turun dan lurus.
13. Dimasukkan ke sampel 1 hingga kurva naik dan belok baru dilakukan pengukuran.
14. Dimasukkan blanko kembali dan dilakukan pengukuran sampel ke 2.
15. Setelah pengukuran selesai, data dapat diperoleh dengan mengklik icon print atau pada baris menu dengan mengklik file lalu print.
16. Apabila pengukuran telah selesai, aspirasikan air deionisasi untuk membilas burner selama 10 menit, api dan lampu burner dimatikan, program pada komputer dimatikan, lalu main unit AAS, kemudian kompresor, setelah itu ducting dan terakhir gas.
Bagian-Bagian pada AAS
a. Lampu Katoda
Lampu katoda merupakan sumber cahaya pada AAS. Lampu katoda memiliki masa pakai atau umur pemakaian selama 1000 jam. Lampu katoda pada setiap unsur yang akan diuji berbeda-beda tergantung unsur yang akan diuji, seperti lampu katoda Cu, hanya bisa digunakan untuk pengukuran unsur Cu. Lampu katoda terbagi menjadi dua macam, yaitu :
Lampu Katoda Monologam : Digunakan untuk mengukur 1 unsur
Lampu Katoda Multilogam : Digunakan untuk pengukuran beberapa logam sekaligus, hanya saja harganya lebih mahal. Soket pada bagian lampu katoda yang hitam, yang lebih menonjol digunakan untuk memudahkan pemasangan lampu katoda pada saat lampu dimasukkan ke dalam soket pada AAS. Bagian yang hitam ini merupakan bagian yang paling menonjol dari ke-empat besi lainnya. Lampu katoda berfungsi sebagai sumber cahaya untuk memberikan energi sehingga unsur logam yang akan diuji, akan mudah tereksitasi. Selotip ditambahkan, agar tidak ada ruang kosong untuk keluar masuknya gas dari luar dan keluarnya gas dari dalam, karena bila ada gas yang keluar dari dalam dapat menyebabkan keracunan pada lingkungan sekitar.
Cara pemeliharaan lampu katoda ialah bila setelah selesai digunakan, maka lampu dilepas dari soket pada main unit AAS, dan lampu diletakkan pada tempat busanya di dalam kotaknya lagi, dan dus penyimpanan ditutup kembali. Sebaiknya setelah selesai penggunaan, lamanya waktu pemakaian dicatat.
b. Tabung Gas
Tabung gas pada AAS yang digunakan merupakan tabung gas yang berisi gas asetilen. Gas asetilen pada AAS memiliki kisaran suhu ± 20000K, dan ada juga tabung gas yang berisi gas N2O yang lebih panas dari gas asetilen, dengan kisaran suhu ± 30000K. regulator pada tabung gas asetilen berfungsi untuk pengaturan banyaknya gas yang akan dikeluarkan, dan gas yang berada di dalam tabung. Spedometer pada bagian kanan regulator merupakan pengatur tekanan yang berada di dalam tabung. Pengujian untuk pendeteksian bocor atau tidaknya tabung gas tersebut, yaitu dengan mendekatkan telinga ke dekat regulator gas dan diberi sedikit air, untuk pengecekkan. Bila terdengar suara atau udara, maka menendakan bahwa tabung gas bocor, dan ada gas yang keluar. Hal lainnya yang bisa dilakukan yaitu dengan memberikan sedikit air sabun pada bagian atas regulator dan dilihat apakah ada gelembung udara yang terbentuk. Bila ada, maka tabung gas tersebut positif bocor. Sebaiknya pengecekkan kebocoran, jangan menggunakan minyak, karena minyak akan dapat menyebabkan saluran gas tersumbat. Gas didalam tabung dapat keluar karena disebabkan di dalam tabung pada bagian dasar tabung berisi aseton yang dapat membuat gas akan mudah keluar, selain gas juga memiliki tekanan.
c. Ducting
Ducting merupakan bagian cerobong asap untuk menyedot asap atau sisa pembakaran pada AAS, yang langsung dihubungkan pada cerobong asap bagian luar pada atap bangunan, agar asap yang dihasilkan oleh AAS, tidak berbahaya bagi lingkungan sekitar. Asap yang dihasilkan dari pembakaran pada AAS, diolah sedemikian rupa di dalam ducting, agar ppolusi yang dihasilkan tidak berbahaya. Cara pemeliharaan ducting, yaitu dengan menutup bagian ducting secara horizontal, agar bagian atas dapat tertutup rapat, sehingga tidak akan ada serangga atau binatang lainnya yang dapat masuk ke dalam ducting. Karena bila ada serangga atau binatang lainnya yang masuk ke dalam ducting , maka dapat menyebabkan ducting tersumbat. Penggunaan ducting yaitu, menekan bagian kecil pada ducting kearah miring, karena bila lurus secara horizontal, menandakan ducting tertutup. Ducting berfungsi untuk menghisap hasil pembakara yang terjadi pada AAS, dan mengeluarkannya melalui cerobong asap yang terhubung dengan ducting
d. Kompresor
Kompresor merupakan alat yang terpisah dengan main unit, karena alat iniberfungsi untuk mensuplai kebutuhan udara yang akan digunakan oleh AAS, pada waktu pembakaran atom. Kompresor memiliki 3 tombol pengatur tekanan, dimana pada bagian yang kotak hitam merupakan tombol ON-OFF, spedo pada bagian tengah merupakan besar kecilnya udara yang akan dikeluarkan, atau berfungsi sebagai pengatur tekanan, sedangkan tombol yang kanan merupakantombol pengaturan untuk mengatur banyak/sedikitnya udara yang akan disemprotkan ke burner. Bagian pada belakang kompresor digunakan sebagai tempat penyimpanan udara setelah usai penggunaan AAS. Alat ini berfungsi untuk menyaring udara dari luar, agar bersih.posisi ke kanan, merupakan posisi terbuka, dan posisi ke kiri meerupakan posisi tertutup. Uap air yang dikeluarkan, akan memercik kencang dan dapat mengakibatkan lantai sekitar menjadi basah, oleh karena itu sebaiknya pada saat menekan ke kanan bagian ini, sebaiknya ditampung dengan lap, agar lantai tidak menjadi basah., dan uap air akan terserap ke lap.
e. Burner
Burner merupakan bagian paling terpenting di dalam main unit, karena burner berfungsi sebagai tempat pancampuran gas asetilen, dan aquabides, agar tercampur merata, dan dapat terbakar pada pemantik api secara baik dan merata. Lobang yang berada pada burner, merupakan lobang pemantik api, dimana pada lobang inilah awal dari proses pengatomisasian nyala api. Perawatan burner yaitu setelah selesai pengukuran dilakukan, selang aspirator dimasukkan ke dalam botol yang berisi aquabides selama ±15 menit, hal ini merupakan proses pencucian pada aspirator dan burner setelah selesai pemakaian. Selang aspirator digunakan untuk menghisap atau menyedot larutan sampel dan standar yang akan diuji. Selang aspirator berada pada bagian selang yang berwarna oranye di bagian kanan burner. Sedangkan selang yang kiri, merupakan selang untuk mengalirkan gas asetilen. Logam yang akan diuji merupakan logam yang berupa larutan dan harus dilarutkan terlebih dahulu dengan menggunakan larutan asam nitrat pekat. Logam yang berada di dalam larutan, akan mengalami eksitasi dari energi rendah ke energi tinggi. Nilai eksitasi dari setiap logam memiliki nilai yang berbeda-beda. Warna api yang dihasilkan berbeda-beda bergantung pada tingkat konsentrasi logam yang diukur. Bila warna api merah, maka menandakan bahwa terlalu banyaknya gas. Dan warna api paling biru, merupakan warna api yang paling baik, dan paling panas, dengan konsentrasi
Buangan pada AAS
Buangan pada AAS disimpan di dalam drigen dan diletakkan terpisah pada AAS. Buangan dihubungkan dengan selang buangan yang dibuat melingkar sedemikian rupa, agar sisa buangan sebelumnya tidak naik lagi ke atas, karena bila hal ini terjadi dapat mematikan proses pengatomisasian nyala api pada saat pengukuran sampel, sehingga kurva yang dihasilkan akan terlihat buruk. Tempat wadah buangan (drigen) ditempatkan pada papan yang juga dilengkapi dengan lampu indicator. Bila lampu indicator menyala, menandakan bahwa alat AAS atau api pada proses pengatomisasian menyala, dan sedang berlangsungnya proses pengatomisasian nyala api. Selain itu, papan tersebut juga berfungsi agar tempat atau wadah buangan tidak tersenggol kaki. Bila buangan sudah penuh, isi di dalam wadah jangan dibuat kosong, tetapi disisakan sedikit, agar tidak kering.
Keuntungan metode AAS
Keuntungan metode AAS dibandingkan dengan spektrofotometer biasa yaitu spesifik, batas deteksi yang rendah dari larutan yang sama bisa mengukur unsur-unsur yang berlainan, pengukurannya langsung terhadap contoh, output dapat langsung dibaca, cukup ekonomis, dapat diaplikasikan pada banyak jenis unsur, batas kadar penentuan luas (dari ppm sampai %). Sedangkan kelemahannya yaitu pengaruh kimia dimana AAS tidak mampu menguraikan zat menjadi atom misalnya pengaruh fosfat terhadap Ca, pengaruh ionisasi yaitu bila atom tereksitasi (tidak hanya disosiasi) sehingga menimbulkan emisi pada panjang gelombang yang sama, serta pengaruh matriks misalnya pelarut.
nadinlove.blogspot.co.id/2012/03/kimia-analisa-instrument.html